岡山大学異分野融合先端研究コアの仁科勇太准教授らの研究グループは、 黒鉛 1 から 酸化グラフェン 2 を合成する過程を追跡し、黒鉛が酸化されて剥がれていく反応をリアルタイムで観察することに成功。 酸化グラフェンの形成メカニズムを世界で初めて解明しました。これは亜硝酸までの酸化でよく、反応に有機炭素元が不要であり、活性も高い脱窒素菌を使ったシステムです。 脱窒素反応が遅滞なく進行するための条件 混合培養液に溶存酸素が存在しないこと。 適当な水素供与体が適量存在すること。 化学 酸化還元反応式の作り方 濃硝酸と銅の酸化還元反応についてわからないところがあります。半反応式どうしをたしてイオン反応式まではできましたが、問題集の解説には2NO3+Cu+2H→2NO2+2 質問No
希硝酸の半反応式の作り方 化学のグルメ
硝酸 作り方 反応式
硝酸 作り方 反応式-半反応式の作り方(有機物酸化(ch 2 o → hco 3 - )の例) 水中のホルムアルデヒド(ch 2 o)が酸化されて、炭酸水素イオン(hco 3)が発生する半反応式を作ります。 先の例では、二酸化炭素(co 2 )が発生する式を作りましたが、水中で二酸化炭素は即座に炭酸水素イオンに変わるので、こちら硝酸アンモニウムの生産方法は中和法と転化法の2 種類がある。設備とコストの点では、 中和法が主流である。転化法はほとんど淘汰された。 中和法は硝酸とアンモニアを中和させ、硝酸アンモニウムを合成する方法である。 反応式: nh 3 hno 3 = nh 4 no 3



亜鉛と希硝酸 濃硝酸の反応式の作り方を教えていただけませんで Yahoo 知恵袋
同僚が「銅アンモニアレーヨンの合成」実験を3年生用にに企画しました。 これを追試・予備実験します。 上記の実験書(1)(2)(3)の写真 (2)では2mol/L NaOH水溶液をゆっくり5mL加えました。 さらに、(4)の写真 沈殿を三角フラスコにとり、濃アンモニア水を溶けるまで少しづつ加えます。硝酸銀 銅 銀 硝酸銅 (2) 酸化還元反応と考えると次のようになる。 Cu → Cu 2+ +2e - ①式 (酸化反応) (e - は電子) Ag+ + e - → Ag ②式 (還元反応)エタノールと硝酸の反応 SI さん 質問日時: 00 アルカリの中和のため、硝酸とエタノールの1:1混合溶液を使うのですが、硝酸とエタノール混合液を放置して置くと沸騰して黄色いガスが出てきました。 置いておくと反応してしまうものなの
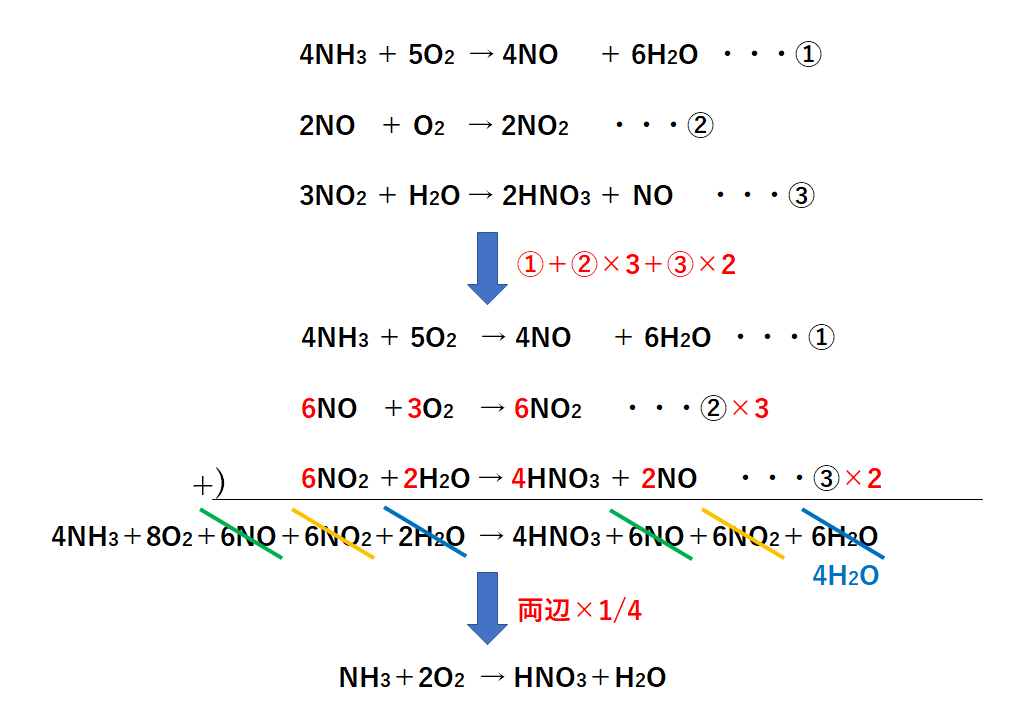
(3)方沵(2)の原理について ビャブモルと銅(Ⅱ)゜アルの酸化還元反応は次のように暯ける。 2hcho + cu + 2oh - → hcooh + cu + h 2o 方沵(2) の゚では細かい傷を内壁につけることが目的である。同ゞでケゲ(Ⅱ)゜アルを 化学反応式は化学の基本中の基本です。 理系の方はもちろん、文系の方も化学基礎をセンター試験で使うことでしょう。 高校化学は中学理科と違い、 単なる暗記だけでは化学反応式を作ることは難しく なってきます。 そこで今回は、文理問わず化学を使う方を対象に化学反応式の作り方 3 N O 2 H 2 O → 2 H N O 3 N O 全体式 N H 3 2 O 2 → H N O 3 H 2 O この反応式は、上記STEP1〜3の反応式を足し合わせることによって作られる。 ※オストワルト法について詳しくは 硝酸の工業的製法「オストワルト法」(触媒・覚え方・仕組み・反応式など
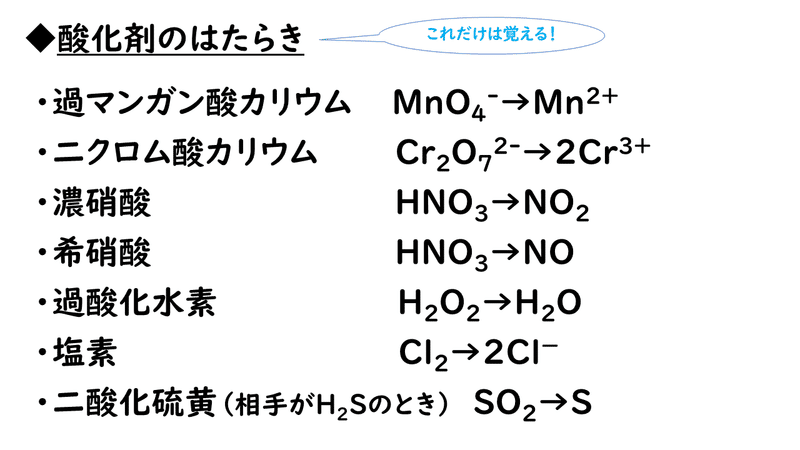
この半反応式は水素イオンや水による調整は必要ないのでこれで完成です。このようにして酸化剤と還元剤の両方の半反応式ができました」 Fe 2 → Fe 3 e – ④「次に、2段階目のイオン反応式を作ります。イオン反応式の作り方は 半反応式から電子を消去1.酸化・還元の半反応式を組み合わせる。 2.h がある場合は,酸の陰イオンを組み合わせる。 cu , h2so4(熱濃硫酸)→so2 cu , hno3(希硝酸)→no cu , hno3 (濃硝酸)→no2 金属が溶けて,h2 以外の気体(so 2,no,no )を発生する場合 反応式の作り方2反応式をわかっていると硝酸の作り方がわかります。 覚えるのは次の3つ。 ①4NH₃5O₂→4NO6H₂O (白金触媒・800℃) ②2NOO₂→2NO₂
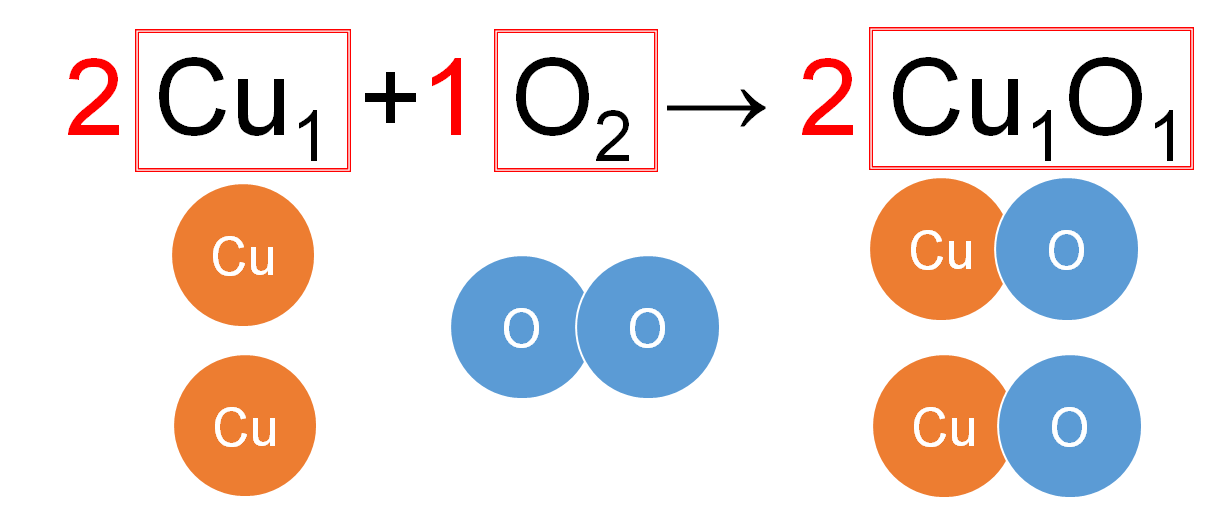



中2化学 質量保存の法則 中学理科 ポイントまとめと整理
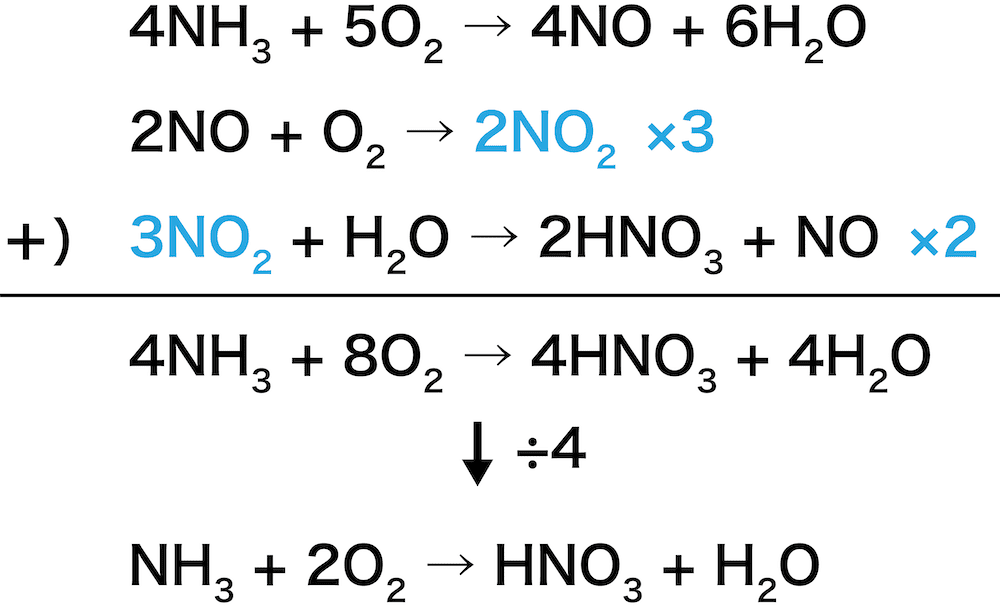



硝酸の工業的製法 オストワルト法 触媒 覚え方 仕組み 反応式など 化学のグルメ
実験では、液面近くが、空気中の酸素と反応するため、わずかに褐色になっているのが観察できます。 2no o 2 → 2no 2 一酸化窒素 nO を効率よく捕集するためには、希硝酸の濃度を抑えて、反応の様子を見ながら必要に応じて加熱するくらいがいいでしょう。亜硝酸菌と、硝酸菌は共に炭酸ガスを唯一の炭素源として細胞合成を行う独立栄養性細菌です。 亜硝酸菌の生物酸化反応 この反応の結果、混合液のpHは低下します。 この反応で生成された亜硝酸態窒素を、硝酸細菌が生物酸化させます。 硝化菌の生物酸化A ベストアンサー so3とh2oの反応の条件で、硫酸と希硫酸になるわけではありません。 特 徴|甘い。 半反応式の作り方(硝酸呼吸の例) 硝酸呼吸(硝酸還元)の半反応式を作ります。




硝酸 Wikipedia



中3化学 アンモニアの利用 中学理科 ポイントまとめと整理
方と注意事項を示す。また,実験2および3では,酸化力 の強い酸とイオン化傾向の小さい金属との反応を考察する ため,濃塩酸,濃硝酸,王水と金,銀の反応を観察する代 表的な方法を紹介する 1)。口絵8 ページ参照。 2 実 験 実験1王水をつくる 硝酸は酸化剤として働きますが、濃硝酸か希硝酸かで酸化剤としての式が異なります。 「希硝酸の方が強い酸化剤である」ということをしっかりと覚えておけば大丈夫です。 ここまで半反応式の作り方や覚え方を学んできたあなたに肝心の「酸化還元半反応式の作り方(有機物酸化(ch 2 o → hco 3 - )の例) 水中のホルムアルデヒド(ch 2 o)が酸化されて、炭酸水素イオン(hco 3)が発生する半反応式を作ります。 先の例では、二酸化炭素(co 2 )が発生する式を作りましたが、水中で二酸化炭素は即座に炭酸水素イオンに変わるので、こちら




化学授業ふり返り Kumonotaira




夕凪亭別館 写真館 10 化学反応式
硝酸水銀(I)(しょうさんすいぎん(I)、英 Mercury(I) nitrate )は水銀の硝酸塩で、化学式Hg 2 (NO 3) 2 で表される無機化合物。 反応 水銀と希硝酸との反応により得られる。 この際濃硝酸を使用すると硝酸水銀(II)が生じる。 還元性を持ち、空気に触れると酸化する。水溶液にすると酸化を遅らせる化学反応式の基礎知識と8つの重要な化学反応式の作り方 手順4:分母を払って、アルファベットに対応した数字が求める係数 反応式の係数に分数がつくとまずいので、これらをまとめて、 整数になる様 反応は暗記でもよいですが 作り方を覚えておくといいと思います これは酸化還元反応です 銀と濃硝酸 HNO3 + H + e → NO2 + H2O Ag → Ag + e 銀と希硝酸 HNO3 + 3H + 3e → NO + 2H2O Ag → Ag + e これから反応式をつくると 上記の式が出来上がります 補足




高校生物 化学合成細菌 映像授業のtry It トライイット




硝酸の化学式はhno なのに 硝酸カリウム水溶液はkno になるのは何故ですか Clear
No2ガス を水に吸収させ, 式の反応により硝酸を生 成する 。 3no2+h → 21'in oa+no (3) この 反応も発熱反応であり,温度を下げ,圧力を上げる ことにより,吸収による硝酸の生成が進む。反応式からわ かるように3分子の no2が吸収されると1分子のnoが反応式(1) 2ag 2oh→ ag 2 o h 2 o 反応式 (2) ag 2 o h 2 o 4nh 3 → 2ag(nh 3) 2 2ohこのアンミン錯体に対して還元剤を作用させると、銀イオンが還元されて銀が析出してきます。 これが銀鏡反応です。 今回の実験ではブドウ糖を還元剤として用いますが硝酸は 硫酸 中では 塩基 として挙動しプロトン化を受け、脱水により ニトロイルイオン (nitroyl / NO 2) を生成する。 濃硝酸と濃硫酸を混合した 混酸 中では以下のような 化学平衡 が成立している。




化学授業ふり返り Kumonotaira




酸化剤 還元剤の半反応式の作り方 Clear
酸化剤オゾンo3の半反応式の作り方で困っています。 資料集に書いてある半反応式の作り方では 1.酸化剤を左辺に、その反応生成物を右辺に書く。 2.酸化剤の酸化数の変化を調べ、電子e-を左辺に加える。4.硝酸(hno 3 )と過塩素酸(hclo 4 )と炭酸ナトリウム(na 2 co 3 )の中和反応式は覚えておいた方がいいです。中和反応式は、2hno 3 (2hclo 4) na 2 co 3 → 2nano 3 (2naclo 4) co 2 h 2 oです。 半反応式の書き方をマスターするためには2つ必要です。 「キーワード」単体 化合物 化学反応式 「準 備」「操 作」web非公開 「注 意」 1 濃アンモニア水を使用するため換気に十分注意する。 2 保護メガネ必須。使用済みの器具やろ紙等は乾燥する前に手早く処理すること。




半反応式の作り方を解説 酸化剤 還元剤の見分け方と一覧表も 高校生向け受験応援メディア 受験のミカタ



希硝酸の半反応式の作り方 化学のグルメ
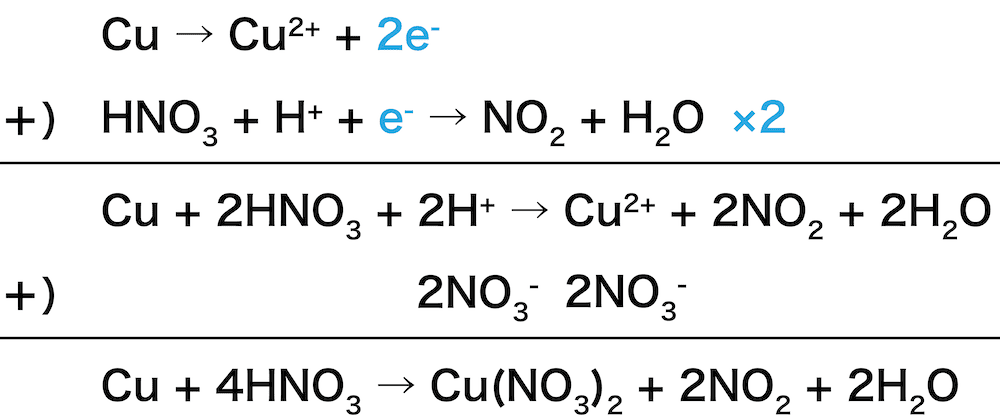
化学反応式を苦手とする人が非常に多いです。 以下の3点をしっかりおさえれば、化学反応式は 難しくありません! ①日本語の式をつくる ②化学式を書く ③原子の数を合わせる では、上記のように水の電気分解の 化学反応式をつくっていきます。8-9 銅と銀の酸化力のある酸との化学反応式 銅と濃硝酸 Cu 4HNO 3 → Cu(NO 3 ) 2 2NO 2 2H 2 O 銅と希硝酸 3Cu 8HNO 3 → 3Cu(NO 3 ) 2 2NO 4H 2 O




高校の化学についてです 硫黄を加熱すると濃硝酸に溶けて硫酸になる 化学 教えて Goo




なのですが教えてください Clear



ニッケルと希硝酸の反応式を教えてください お願いします Yahoo 知恵袋




アルミニウム 酸化鉄 化学反応式




30 化学基礎 酸化剤還元 半反応式の書き方 Youtube




銀が溶けた溶液に少量のアンモニア水を加えた時のイオン反応式をかけ 化学 教えて Goo




等方性ウエット エッチング 日経クロステック Xtech




希硝酸の半反応式の作り方 化学のグルメ




高校化学 硝酸の製法 映像授業のtry It トライイット




高校化学 一酸化窒素の製法と性質 映像授業のtry It トライイット



濃硝酸と希硝酸で 半反応式が違うのは何故ですか 消費できる水素イ Yahoo 知恵袋




希硝酸の半反応式の作り方 化学のグルメ



化学基礎で 銅と希硝酸の反応式の作り方に疑問があります Yahoo 知恵袋



Q Tbn And9gcqyemsl1dnm2c45m5cggovzrdv6i2vy4na9henw 6byv1q9b2g6 Usqp Cau



酸化還元




硝酸の化学式 分子式 構造式 電子式 イオン式 分子量は 硝酸の工業的製法のオストワルト法の反応式は 濃硝酸と銅との反応 希硝酸と銅との反応式は
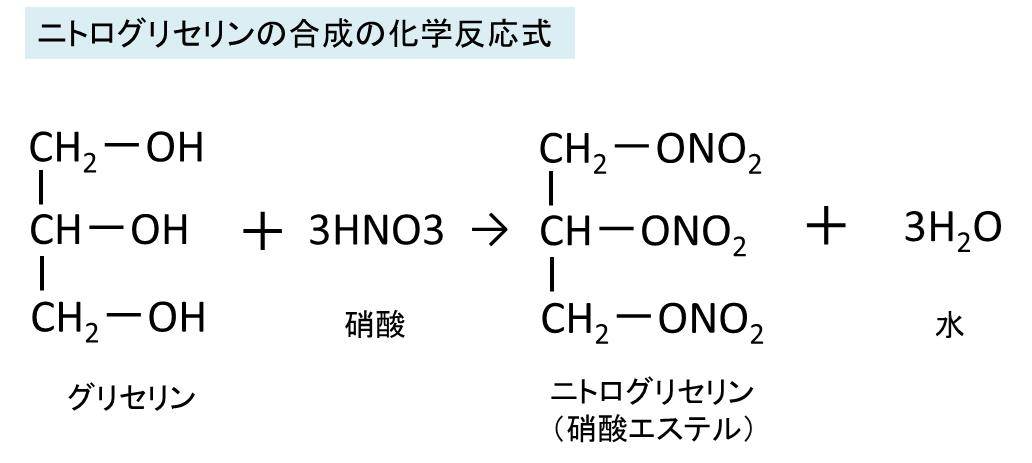



ニトログリセリン C3h5n3o9 の化学式 分子式 構造式 電子式 示性式 分子量は ニトログリセリンの代表的な化学反応式は



亜鉛と希硝酸 濃硝酸の反応式の作り方を教えていただけませんで Yahoo 知恵袋



1



受験基礎化学 19 化学反応式と物質量 みかみの参考書ブログ




高校化学 硝酸の製法 映像授業のtry It トライイット
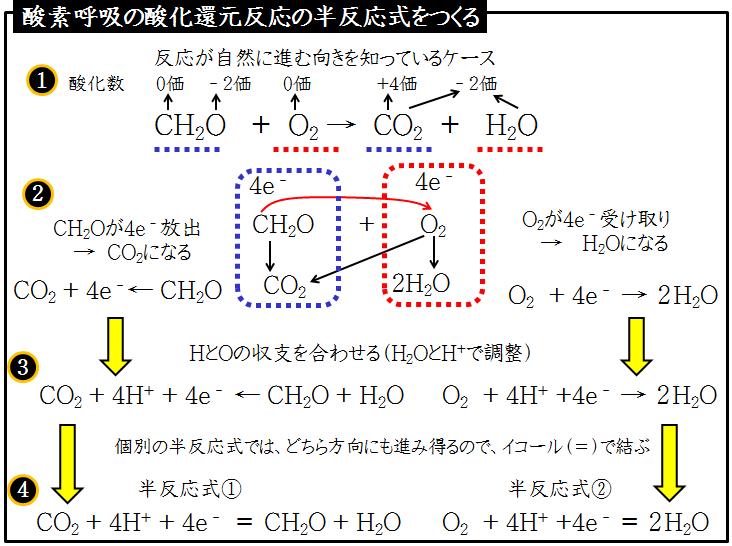



Curso 酸化還元反応 半反応式の作り方 呼吸反応
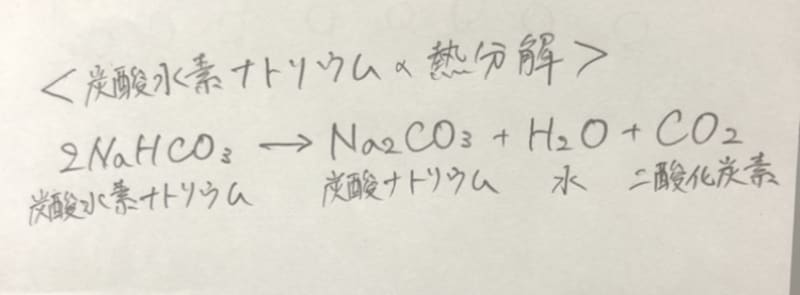



炭酸水素ナトリウムの化学反応式を教えてください アンサーズ




銅と硝酸の化学反応式の解説 Youtube




銅と硝酸の化学反応式の解説 Youtube



1




希硝酸の半反応式の作り方 化学のグルメ




高校化学基礎 イオン反応式の書き方 映像授業のtry It トライイット




硝酸の化学式 分子式 構造式 電子式 イオン式 分子量は 硝酸の工業的製法のオストワルト法の反応式は 濃硝酸と銅との反応 希硝酸と銅との反応式は




化学反応式 計算の仕方 下の画像を見てください オストワルト法の計 その他 応用科学 教えて Goo




書けて欲しい半反応式 6 化学がちょっとだけ好きな社労士




未定係数法をやりたくない人へ 銀および銅と希硝酸 濃硝酸の化学反応式の覚え方 一酸化窒素と二酸化窒素の発生 ゴロ化学基礎 化学 Youtube



オストワルト法の仕組みを解説 受験メモ




オストワルト法とは 化学反応の流れや覚え方も含めて解説 高校生向け受験応援メディア 受験のミカタ
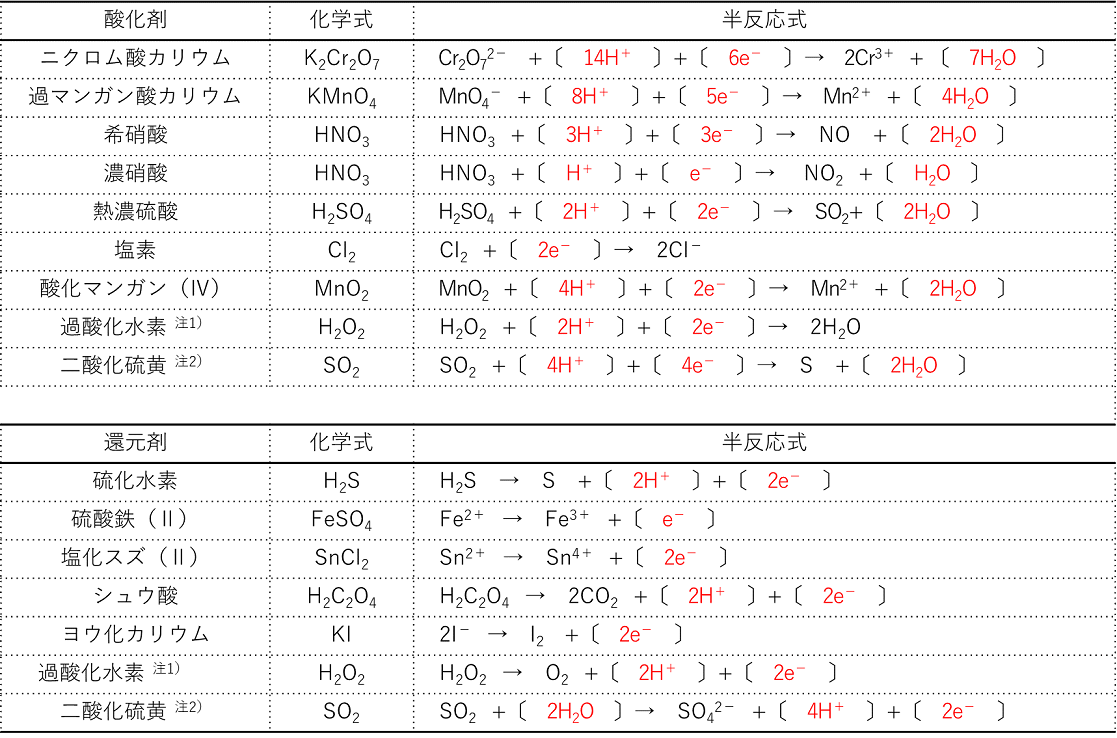



酸化剤と還元剤




硝酸 化学 反応 式




酸化還元反応式の作り方 理系ラボ




半反応式から化学反応式を導く方法は2ステップでok



銀に希硝酸を加える化学反応式なんですが還元剤の半反応式は黒文字だと思うん Yahoo 知恵袋




参加還元の銅と希硝酸との反応の問題なのですが Okwave
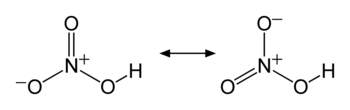



硝酸 Wikipedia




電子e を用いた酸化還元反応式の簡単な作り方があれば教えて頂きたいです 酸化剤と還元 Clear




未定係数法は化学反応式の係数が絶対にわかる裏技だ 三重の個人契約家庭教師



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス



受験基礎化学 19 化学反応式と物質量 みかみの参考書ブログ




酸化還元基礎固め 硝酸と金属の化学反応式の作り方 化学がちょっとだけ好きな社労士



希硝酸の半反応式の作り方 化学のグルメ



硝酸とは コトバンク



Khoa 酸化還元反応 半反応式の作り方 呼吸反応



Curso 酸化還元反応 半反応式の作り方 呼吸反応




夕凪亭別館 写真館 10 化学反応式




銅と希硝酸の化学反応式の問題なのですが なぜ最後に両辺に6つの硝酸イオンを加えるので Clear



希硝酸の半反応式の作り方 化学のグルメ




オストワルト法とは 化学反応の流れや覚え方も含めて解説 高校生向け受験応援メディア 受験のミカタ




硫酸イオンと 硫酸の化学式はなぜ違うのですか 硫酸にはなぜhがつくのに 硫酸イ アンサーズ



窒素の単体と化合物の性質 製法 化学のグルメ




硝酸の分解反応を作る Youtube




銅と熱濃硝酸の化学反応式で 自分は Clear




二酸化窒素 No2 の化学式 分子式 構造式 電子式 イオン式 分子量は 二酸化窒素と水との反応式は




酸化剤 還元剤の半反応式の作り方 Clear




酸化還元基礎固め 濃硝酸と希硝酸 化学がちょっとだけ好きな社労士




希硝酸の半反応式の作り方 化学のグルメ




書けて欲しい半反応式 5 化学がちょっとだけ好きな社労士



希硝酸の半反応式の作り方 化学のグルメ



濃硝酸希硝酸の半反応式について 希硝酸はhno3 希 3h 3e Yahoo 知恵袋



3




のイオン反応式の作り方がわかりません 途中式 を含めて教えてください Clear




硫酸鉄 水溶液と過酸化水素水 硫酸性 の酸化還元反応の全反応式の作り方を教えてい Clear




希硝酸の半反応式の作り方 化学のグルメ



希硝酸の半反応式の作り方 化学のグルメ




イオン化傾向とは 覚え方 電池 金属と腐食 大きさの表 理系ラボ




酸化剤 還元剤の半反応式一覧 4ステップで半反応式は書ける




夕凪亭別館 写真館 10 化学反応式



2 o 問1 次の各化学反応式に係数を入れよ




化学 半反応式 暗記



2 o 問1 次の各化学反応式に係数を入れよ




アンモニアってどんな物質 誕生秘話とともに 未来の科学者ライターが解説 ページ 3 4 Study Z ドラゴン桜と学ぶwebマガジン



半反応式 一覧 覚え方



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Theory Redox Siki




化学反応式の書き方について 理科 苦手解決q A 進研ゼミ高校講座



化学です 銅と濃硝酸の 化学反応式 を考えるときに写真のマーカーで Yahoo 知恵袋




二クロム酸イオンの半反応式の作り方を教えてください 二クロム酸イオ その他 学校 勉強 教えて Goo




未定係数法をやりたくない人へ 銅と希硝酸および濃硝酸の化学反応式の係数の語呂合わせ 銀の反応は概要欄へ 無機化学 ゴロ化学 化学基礎 Youtube




硝酸 Wikipedia



希硝酸の半反応式の作り方 化学のグルメ



銅と濃硝酸の化学反応式の作り方がわかりません 問題には Cuはcu No3 Yahoo 知恵袋




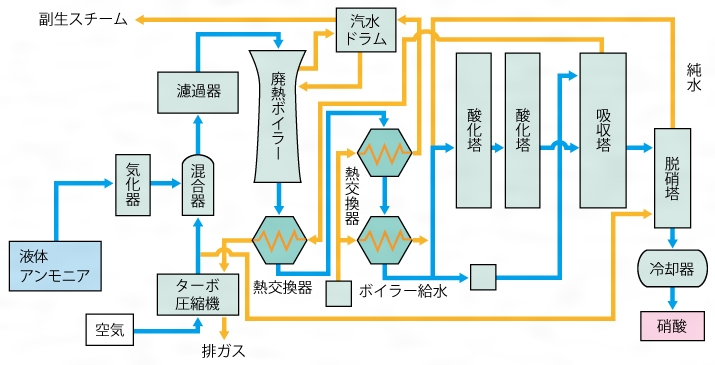
漫画dr Stone 復活液の原料 硝酸の工業的製法を解説 化学工学レビュワー




高校化学 二酸化窒素の製法と性質 映像授業のtry It トライイット




補助教材 銅と希硝酸の反応 Youtube




酸化還元基礎固め 硝酸と金属の化学反応式の作り方 続き 化学がちょっとだけ好きな社労士




化学反応式の作り方がわかりません 反応物が与えられていて生成物がわからないとき どう Clear




ハーバーボッシュ法とオストワルト法 アンモニア 硝酸の製法を解説



0 件のコメント:
コメントを投稿